
在这次采访中,光子Etc生命科学成像应用科学家ÉmilieBeaulieu Ouellet与New-Medical讨论了其临床前红外成像仪的范围以及如何进行癌症检测。
请您告诉我们有关Photon等临床红外成像仪的信息吗?是什么使它们在市场上与众不同?
Photon Etc.(IR VIVO™)系统是首个也是唯一的交钥匙高光谱临床前成像仪,经过优化,可在市场上已有的红外(NIR-II)/短波长红外(SWIR)范围的第二个生物窗口中成像。我们的知识。
我们的产品组合包括该临床前成像仪的不同组件,例如高光谱滤镜(Hypercube™),宽视野红外成像仪(S-EOS和GRAND-EOS)和相机(ZephIR™1.7)。这为我们提供了对临床前系统的高度控制,可以根据客户要求进行定制。
我们的标准IR VIVO™临床前系统可提供波长为730 nm或808 nm的激光或LED照明,这是激发NIR-II标记(例如碳纳米管)的常用波长。对于检测,我们可以提供使用滤光轮的多光谱成像和具有850 nm至1620 nm连续可调光谱范围且光谱分辨率<4 nm的高光谱成像。
该系统还配备了加热板,气体麻醉入口和出口,最多可容纳3只小鼠。可选的扩展包括在可见光中的检测,这意味着除具有进行高光谱和NIR-II成像的能力外,还可以执行标准临床前光学成像仪进行的常规实验。

第二个生物窗口中的成像与其他光学成像波长有何不同?
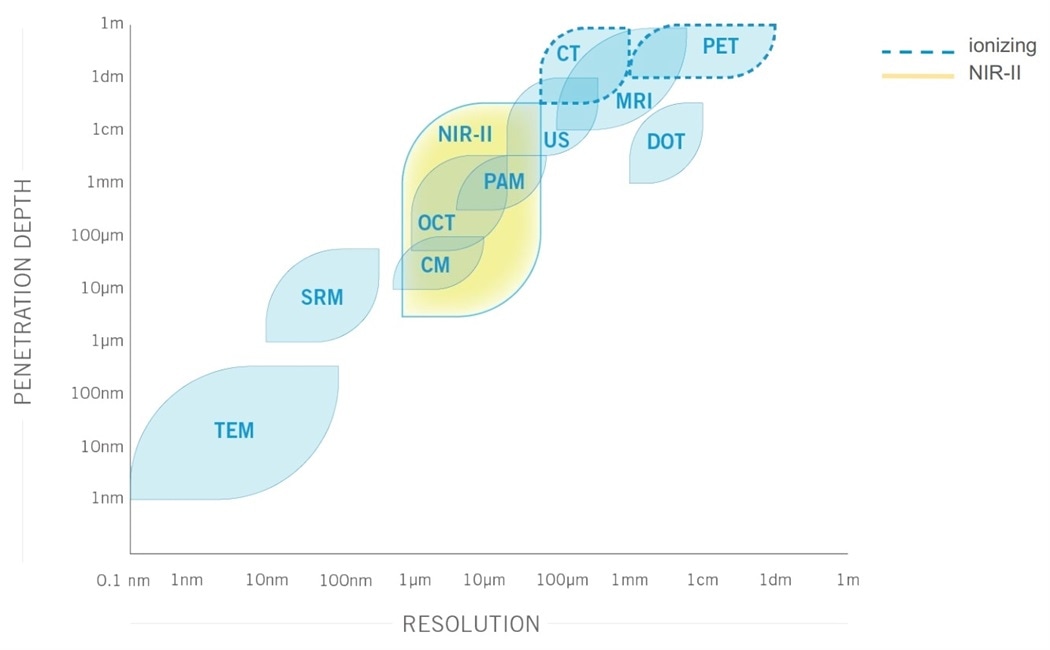
在第二个生物窗口(1000至1700 nm)中成像时,组织的散射减少,组织吸收和自发荧光最小。结果,与传统的可见光或红外光学成像(即400-1000 nm)相比,在这些波长下具有更好的图像对比度,灵敏度和对组织的穿透深度。
在对像老鼠这样的小型动物进行成像时,达到3厘米的穿透深度会产生巨大的影响,因为它可以实时显示整个器官以及细胞过程的高分辨率图像。
与其他小动物成像方式相比,NIR-II具有优势。确实,MRI,PET和CT成像可能需要几分钟到几小时才能完成扫描,对于PET和CT而言,是复杂,昂贵且电离的。
此外,它们不能提供NIR-II成像的微米级分辨率。最后,尽管在第二生物窗口中增加的穿透深度不允许像MRI,PET或CT一样通过整个人体成像,但其穿透深度对于诸如小动物成像,手术指导或肿瘤切除术等应用是理想的。
在这些波长下,在技术方面有什么可用?
市场上有许多红外探测器。为了在第二个生物窗口中成像,基于砷化铟镓(InGaAs)的相机可提供最高的灵敏度。InGaAs摄像机最初仅限于航空航天和军事领域,现在越来越多地可供研究人员使用。
由于集成了四级TE冷却器,Photon Etc.封装了自己的高灵敏度ZephIR™1.7 InGaAs相机,可在-80°C的温度下运行。这种低工作温度允许以极低的噪声水平进行信号检测。
随着短波红外(SWIR)摄像机的普及,研究人员开始测试在这些波长下进行生命科学成像的潜力。他们发现,使用该技术可以实现更好的穿透深度和图像清晰度,并开始开发可在相应波长下使用的生物医学标记。这些荧光标记物对于靶向生物实体必不可少。
一些NIR-II标记物已经可以通过商业途径获得。尽管传统上将其用于约800 nm的成像,但事实证明,临床染料吲哚菁绿(ICG)在1300 nm附近也具有良好的发射。NIR-II成像的部分优势在于,它证明了生物分布研究急需的分辨率,从而释放了在NIR-II中具有长发射尾巴的NIR染料的潜力。
当前正在开发的有前途的标记物包括小分子,量子点,单壁碳纳米管(SWCNT)和稀土纳米粒子。早期结果表明,许多NIR染料具有较长的发射尾巴。现在,额外的成像窗口将大大有利于已经开展的旨在使荧光染料更具针对性的研究计划。NIR-II光学成像提供的更高的分辨率将进一步帮助翻译研究计划的探针开发。
Photon Etc.与开发这些标记的研究人员携手合作,为他们提供开发所需的成像工具。
我们提供了迄今为止市场上为数不多的针对红外成像优化的显微镜之一,IMA™。我们的显微镜提供了进行红外高光谱成像的选项,可以快速表征多个标记的发射波长。
我们还开发了临床前的NIR-II成像仪IR VIVO™,以满足研究第二个生物学窗口的研究人员的需求。

您能告诉我们一些NIR-II成像的示例应用程序吗?
NIR-II成像非常适合以高清晰度快速可视化深层,小解剖特征。样品应用包括血流,淋巴或代谢成像。肿瘤检测或细胞环境评估(脂质或microRNA含量,pH,温度等)是其他示例,将在稍后讨论。
与血流有关的疾病,例如外周动脉疾病,影响了美国数百万人。缺血小鼠模型被用于开发改善血流恢复的疗法。研究表明,NIR-II成像可用于监测与微血管形成有关的过程,例如小动物的组织灌注,心率或血流。
实际上,NIR-II既可以以比μCT成像更高的空间分辨率可视化小型微血管,又可以以匹配超声的速度进行血流定量。这些功能还与活动状态的功能成像有关,例如肌肉活动或大脑对刺激的反应,这些活动与灌注密切相关。
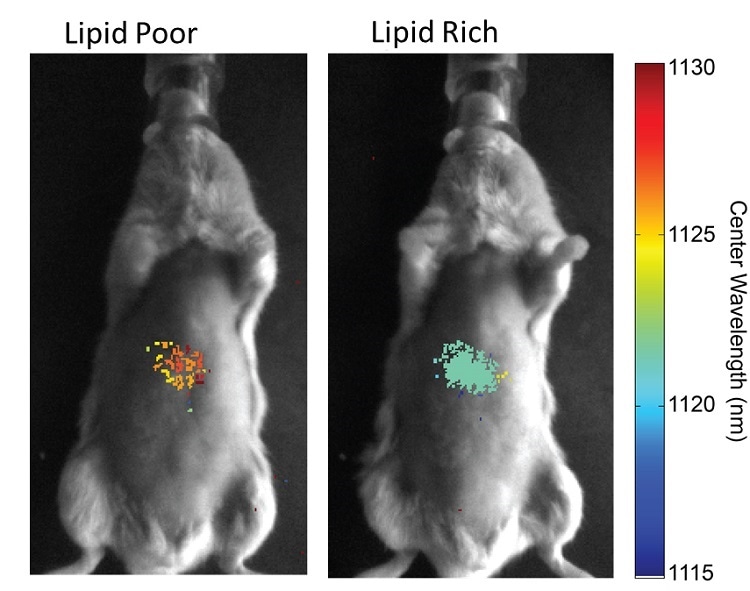
正在开发各种NIR-II标记或传感器,以利用这些波长下的高穿透深度。例子包括允许检测脂质或微小RNA含量的碳纳米管传感器。取决于细胞环境,碳纳米管的发射波长将发生偏移,因此可以实时绘制脂肪含量。
已经表明,小鼠饮食的变化反映了脂质含量的变化。预期这将为脂肪肝疾病的检测和治疗提供更好的见解。同样,可以通过波长偏移评估microRNA含量。在许多情况下,特定的microRNA表达模式是良好的疾病指标。
NIR-II成像仪可以识别癌症吗?这会产生什么影响?
NIR-II成像由于其固有的组织特性或通过使用靶向标记物,可以进行癌症检测。与可见成像相比,增加的穿透深度和对比度可以更好地描绘肿瘤边缘或评估肿瘤体积。
就肿瘤成像指标而言,由于减少了背景自发荧光和在这些波长下的组织散射,使用NIR-II标记物可显着改善肿瘤与正常(T / NT)的比率。这意味着提高了在早期阶段检测肿瘤的能力。
出于研究目的,在早期阶段检测肿瘤并监测其进展可能使人们更好地了解肿瘤发生并有助于评估治疗效果。NIR-II还可以监测血管活性,该活性与通过血管生成引起的肿瘤生长密切相关。
在临床上,NIR-II成像有潜力成为术中图像引导肿瘤切除的高度灵敏,快速且廉价的工具。利用开发出的靶向癌症的适当标记物,NIR-II成像可以减少手术切缘阳性的发生率,从而减少癌症复发的风险。

NIR-II成像对临床前成像的未来意味着什么?
与当前的临床前成像技术相比,NIR-II成像将以更低的成本将快速,高分辨率和穿透深度成像带来前所未有的组合,并为更广阔的社区带来了收益。
这将能够解决和追踪整个小型动物的单一生物医学目标或过程,从而为基础和生物药物研究打开新的可能性。
关于ÉmilieBeaulieu Ouellet
ÉmilieBeaulieu Ouellet是一名受过培训的生物医学工程师,是Photon Etc生命科学成像的应用科学家。在蒙特利尔理工大学攻读研究生期间,她专注于生物光子学,尤其是显微镜和内窥镜的设计。
Émilie随后在尼康仪器公司担任生物系统现场支持专家和显微镜系统技术代表。她后来加入哈佛医学院的Tearney小组,担任光学工程师,设计和制造用于胃肠成像的内窥镜。
Émilie拥有10年的生物光子学经验,并且广泛接触生命科学的各种应用程序,致力于将生物光子学的最新创新带入生命科学市场。
REFERENCES
(i) Dion-Bertrand, L.-I. (2016). Hyperspectral Microscopy: A Powerful Technique for Multiplexed Imaging. Biophotonics, 23(8), 20–22.
Antaris, A. L., Chen, H., Cheng, K., Sun, Y., Hong, G., Qu, C., … Dai, H. (2016). A small-molecule dye for NIR-II imaging. Nature Materials, 15(2), 235–242. https://doi.org/10.1038/nmat4476
Ding, F., Zhan, Y., Lu, X., & Sun, Y. (2018). Recent advances in near-infrared II fluorophores for multifunctional biomedical imaging. Chemical Science, 9(19), 4370–4380. https://doi.org/10.1039/c8sc01153b
Bardhan, N. M., Dang, X., Qi, J., & Belcher, A. M. (2018). US 2018/0042483 A1. United States.
Dion-Bertrand, L.-I. (2016). Hyperspectral Microscopy: A Powerful Technique for Multiplexed Imaging. Biophotonics, 23(8), 20–22.
Lessard, Simon & Dion-Bertrand, Laura-Isabelle. (2017). COOLING SWIR SENSORS - AN OVERVIEW. 10.13140/RG.2.2.31365.65764.
Jena, P. V., Roxbury, D., Galassi, T. V., Akkari, L., Horoszko, C. P., Iaea, D. B., … Heller, D. A. (2017). A Carbon Nanotube Optical Reporter Maps Endolysosomal Lipid Flux. ACS Nano, 11(11), 10689–10703. https://doi.org/10.1021/acsnano.7b04743
Bruns, O. T., Bischof, T. S., Harris, D. K., Franke, D., Shi, Y., Riedemann, L., … Bawendi, M. G. (2017). Next-generation in vivo optical imaging with short-wave infrared quantum dots. Nature Biomedical Engineering, 1(4). https://doi.org/10.1038/s41551-017-0056
Hong, G., Lee, J. C., Jha, A., Diao, S., Nakayama, K. H., Hou, L., … Huang, N. F. (2014). Near-Infrared II Fluorescence for Imaging Hindlimb Vessel Regeneration with Dynamic Tissue Perfusion Measurement Guosong. Circ Cardiovasc Imaging, 7(3), 517–525. https://doi.org/10.1161/CIRCIMAGING.113.000305
Franke, D., Harris, D. K., Chen, O., Bruns, O. T., Carr, J. A., Wilson, M. W. B., & Bawendi, M. G. (2016). Continuous injection synthesis of indium arsenide quantum dots emissive in the short-wavelength infrared. Nature Communications, 7, 1–9. https://doi.org/10.1038/ncomms12749
Ghosh, D., Bagley, A. F., Na, Y. J., Birrer, M. J., Bhatia, S. N., & Belcher, A. M. (2014). Deep, noninvasive imaging and surgical guidance of submillimeter tumors using targeted M13-stabilized single-walled carbon nanotubes. Proceedings of the National Academy of Sciences, 111(38), 13948–13953. https://doi.org/10.1073/pnas.1400821111
Antaris, A. L., Chen, H., Cheng, K., Sun, Y., Hong, G., Qu, C., … Dai, H. (2016). A small-molecule dye for NIR-II imaging. Nature Materials, 15(2), 235–242. https://doi.org/10.1038/nmat4476
Galassi, T. V., Jena, P. V., Shah, J., Ao, G., Molitor, E., Bram, Y., … Heller, D. A. (2018). An optical nanoreporter of endolysosomal lipid accumulation reveals enduring effects of diet on hepatic macrophages in vivo. Science Translational Medicine, 10(461), 1–10. https://doi.org/10.1126/scitranslmed.aar2680
